酸化銀の熱分解とは?
酸化銀ってどんな物質?
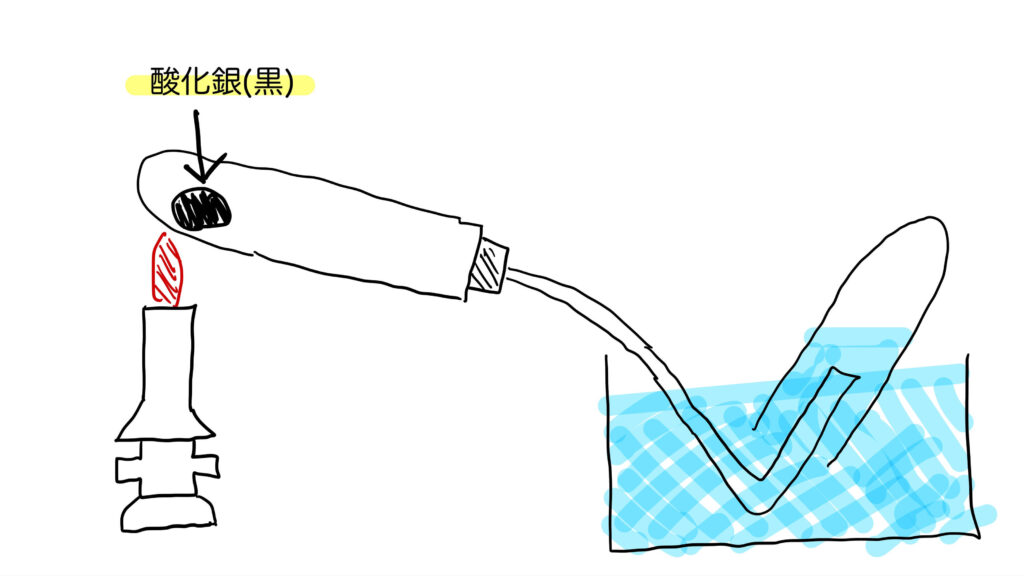
酸化銀(さんかぎん)は、黒色の粉末状の物質で、化学式は Ag₂O です。
「銀」という名前がついていますが、見た目はピカピカしておらず、黒い粉に見えます。
理科の実験では、「加熱すると分解する物質」として登場することが多いです。金属である銀が、なぜ黒い酸化銀の形で存在するのか?それは、銀が空気中の酸素と反応してできた酸化物だからです。
熱分解の化学反応式
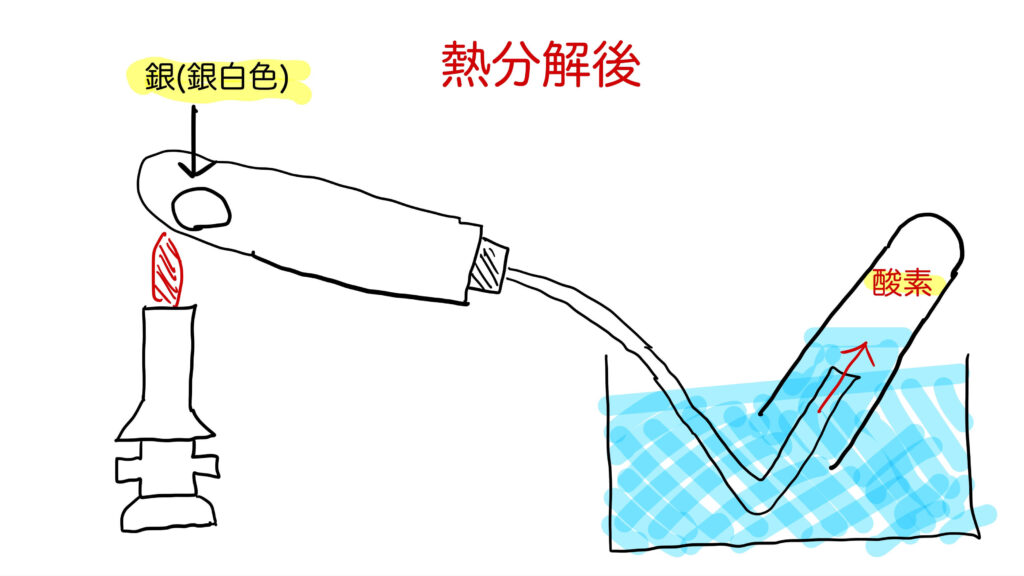
酸化銀は、加熱すると2つの物質に分かれます。それが、銀(Ag)と酸素(O₂)です。
そのときの化学反応式は以下の通りです:
2Ag₂O → 4Ag + O₂中学生の理科ではよく出る基本的な反応なので、化学反応式とあわせてしっかり覚えておきましょう!
このように、熱を加えることで、1つの化合物が2つ以上の物質に分かれる反応のことを「熱分解」といいます。
また、酸化銀から酸素が取り除かれるので還元反応でもあります。
「酸化銅の還元」とはどう違う?
酸化銅(CuO)を銅に戻す(=還元する)ためには、炭素(C)などの別の物質が必要です。
たとえば、酸化銅の還元反応はこうです:
2CuO + C → 2Cu + CO₂この反応では、炭素が酸素をうばって二酸化炭素(CO₂)になることで、酸化銅から銅が取り出されます。
銀ができたことを確認しよう
酸化銀を加熱すると、黒かった粉がだんだん銀色に変わっていくのがわかります。これは、銀(Ag)ができた証拠です。でも、それだけでは「本当に銀なのか?」と疑いたくなるかもしれません。ここでは、できた物質が金属の銀であることを確認する方法を紹介します。
こすって光る?銀の金属光沢の実験
加熱した後に残った銀色の物質を、ガラス棒や金属ヘラなどでこすってみると……
👉 ピカッと光ります!
これは「金属光沢(きんぞくこうたく)」と呼ばれる、金属に特有の性質です。金属は表面をこすると、つるつるになって光を反射するようになります。
つまり、「こすって光る」ということは、金属である証拠なんです。
この実験によって、加熱後にできた銀色の物質は「金属の銀(Ag)」であることがわかります。
銀は金属だけど、なぜ黒かった?
「でも…銀ってもともとピカピカな金属じゃないの?最初はなんで黒かったの?」と不思議に思った人もいるかもしれません。
その理由は、銀が空気中の酸素と結びついて酸化銀(Ag₂O)になっていたからです。酸化されると、銀は黒い粉の状態になります。
酸化銀は「銀(Ag)」と「酸素(O₂)」がくっついた化合物です。これを加熱によって分解(熱分解)することで、元の銀(金属)と酸素(気体)に戻すことができます。
つまり、
- 黒い酸化銀(Ag₂O)
↓(加熱) - 銀色の銀(Ag)と酸素(O₂)
という変化をしていたのですね。
酸素ができたことを確認しよう
酸化銀を加熱すると、銀だけでなくもう一つの物質、酸素(O₂)も発生します。でも、酸素は無色・無臭の気体なので、見ただけでは出てきたかどうかわかりません。
そこで、酸素が本当に発生しているのかを実験で確認する方法を紹介します。
線香の火が激しく燃えるのはなぜ?
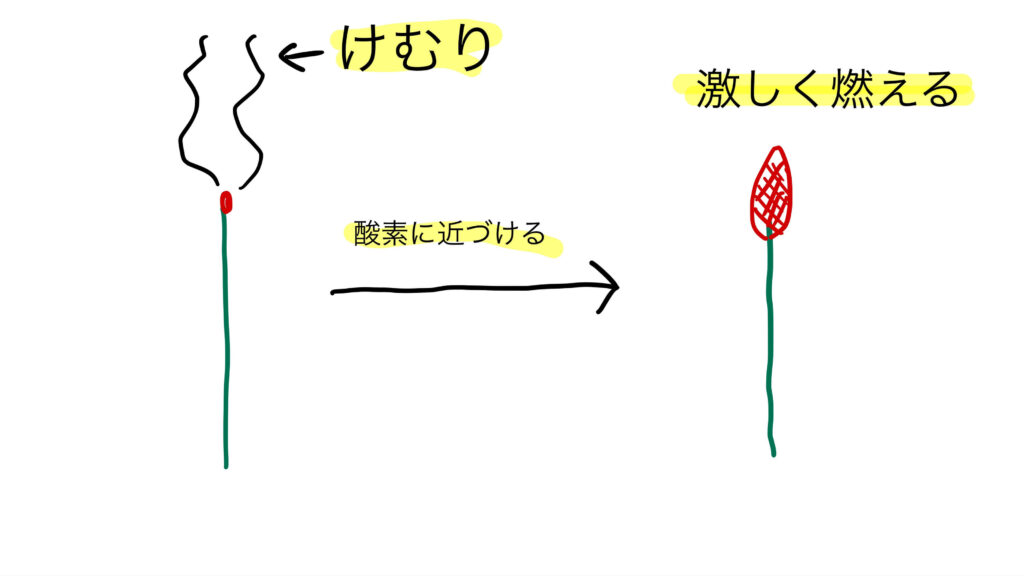
酸素があるかどうかを調べるには、「線香(せんこう)を使った実験」がよく使われます。
- まず、線香に火をつけて、いったん炎を吹き消します。
- 煙が出て、火種(ひだね)だけが残っている状態にします。
- その線香を、酸化銀の加熱で発生した気体に近づけると……
👉 パッと炎がついて激しく燃える!
これは、酸素の中ではものが燃えやすくなる性質があるからです。酸素は「助燃性(じょねんせい)」がある気体なので、火がつきやすくなります。
この実験によって、発生した気体が酸素であることが確認できるのです。
酸素は水上置換法で集めよう
発生した酸素を目に見える形で集めたいときには、「水上置換法(すいじょうちかんほう)」を使います。
これは、水の中で出てきた気体を上に押し出すようにして集める方法です。
やり方は以下の通りです:
- 水の入った水槽(すいそう)と、試験管を用意します
- 試験管の口を下にして、水の中に沈めます
- 気体が発生すると、試験管の中の水を押し出して、代わりに酸素がたまっていきます
こうすれば、目に見えない酸素を試験管の中に閉じこめて、あとから実験で使えるようになります。
なぜ酸素は水上置換法で集めるの?
水上置換法は、気体の集め方の中でも「水にあまり溶けない気体」に使われます。
酸素は少しだけ水に溶けますが、ほとんどは溶けずにそのまま上にのぼっていくため、水上置換法でうまく集められるのです。
ちなみに、水にとてもよく溶ける気体(例:アンモニア)はこの方法では集められません。気体の性質によって、適切な集め方が変わるというのも、理科の面白いポイントですね。
まとめ|酸化銀の熱分解のポイント
ここまで、酸化銀の熱分解についてくわしく学んできました。最後に、大事なポイントを3つにしぼってふり返っておきましょう。
化学反応式をしっかり覚えよう
酸化銀の熱分解で使われる化学反応式は、中学理科でもとくに出やすいです。
2Ag₂O → 4Ag + O₂という形でも覚えておきましょう。
- Ag₂O(酸化銀)が
- Ag(銀)と O₂(酸素)に分かれる
という反応です。
銀と酸素の確認方法は定期テストにも出やすい!
反応後にできた銀と酸素が本物かどうか、実験で確かめる方法もとても大切です。
- 銀:こすって金属光沢が出るかどうかで確認
- 酸素:火のついた線香が激しく燃えるかで確認
- 酸素の集め方:水上置換法
どれもテストでよく出るポイントなので、実験の手順や意味をセットで覚えておきましょう。
還元反応との違いも理解しておこう
酸化銀の熱分解は、「熱だけで分解する反応」=熱分解です。
一方で、酸化銅や酸化鉄は炭素などと一緒に加熱して金属を取り出す必要があるので、還元反応になります。
| 反応の種類 | 特徴 | 例 |
|---|---|---|
| 熱分解 | 熱だけでOK | 酸化銀 → 銀 + 酸素 |
| 還元反応 | 別の物質(炭素など)が必要 | 酸化銅 + 炭素 → 銅 |
この違いをおさえておくことで、より深く理解できます!
この単元は、化学反応式の書き方・気体の性質・金属の特徴など、理科のいろいろな知識とつながっています。
しっかり復習して、自信をもって定期テストにのぞみましょう!💪