酸化銅の還元とは?|中学生でもわかる化学変化のしくみ
「還元」とは何か?
中学理科で出てくる「還元(かんげん)」とは、酸素をうばわれる変化のことです。
たとえば、赤色の金属「銅(Cu)」は、加熱すると酸素とくっついて「酸化銅(CuO)」という黒い粉になります。これは酸化です。
いっぽうで、この酸化銅から酸素をうばい取って、もとの銅に戻すことを「還元」と言います。
🔍 ポイント:
「酸化」…酸素とくっつく
「還元」…酸素を失う
銅は、本来は赤っぽい金属です。でも、酸素とくっついて酸化されると黒くなります。
還元の実験では、黒い酸化銅を赤い銅に戻すことができます。つまり、「酸素をうばわれた」ことで、元の金属に“戻った”のです。
🧠 イメージで覚えよう
- 酸化銅 → 黒い粉
- 還元 → 酸素をうばって赤い銅が出てくる!
- 「銅を取り戻す」イメージでOK!

酸化銅を炭素で還元する実験|石灰水で二酸化炭素を確認!
実験のしかたと化学反応式
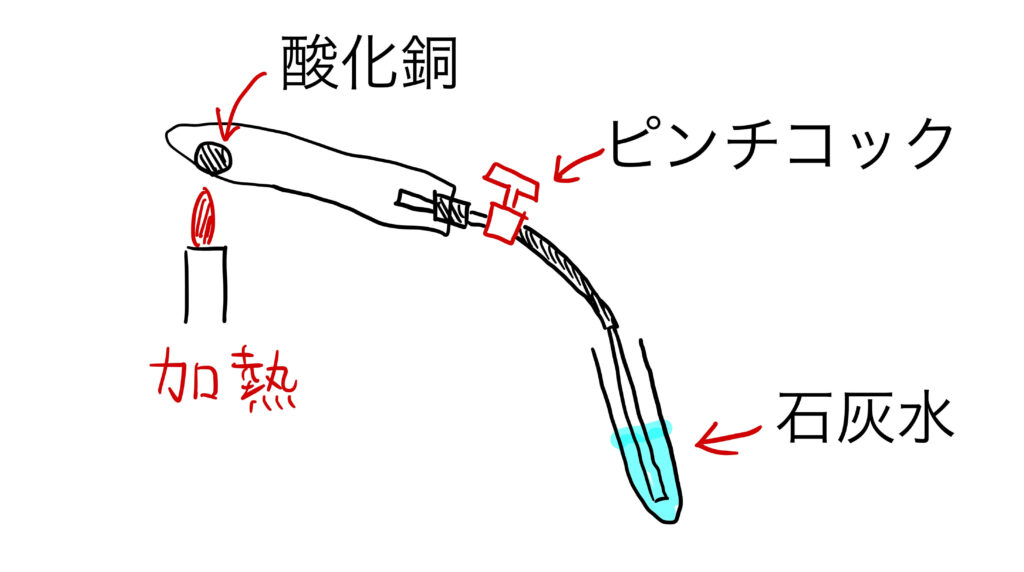
酸化銅(CuO)は黒い粉のような見た目をしています。これに炭素(C)の粉をまぜて加熱すると、酸化銅から酸素がうばわれて、赤い金属の銅(Cu)が出てきます。これが還元です。
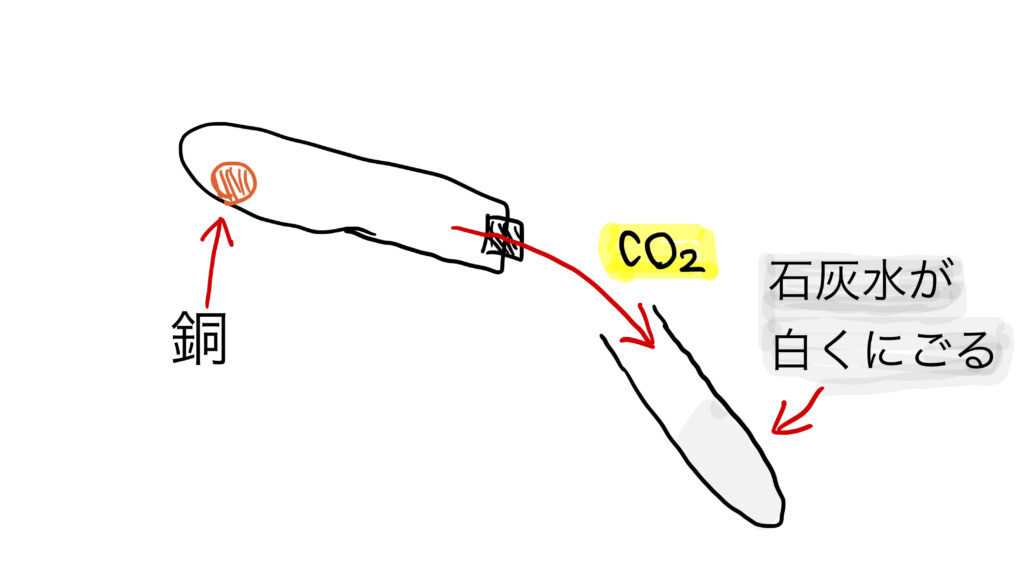
そのとき、炭素は酸素と結びついて**二酸化炭素(CO₂)**になります。
このときの化学反応式は次のとおりです:
2CuO + C → 2Cu + CO₂
- CuO(酸化銅)…黒い粉
- C(炭素)…黒い粉
- Cu(銅)…赤い金属
- CO₂(二酸化炭素)…気体で発生する
つまり、加熱することで、黒い粉が赤い金属に変わる様子が見えるのです。
二酸化炭素の確認|石灰水が白くにごる!
この実験では、本当に二酸化炭素が出ているのかを確認するために、石灰水(せっかいすい)を使います。
石灰水には、二酸化炭素がふくまれると白くにごる性質があります。
✅ なぜ白くにごる?
二酸化炭素が石灰水に入ると、「炭酸カルシウム(CaCO₃)」という白い物質ができるからです。
【確認方法】
- 実験装置の出口にガラス管をつなげる
- その先に石灰水を入れた試験管を用意する
- 加熱を始めると、ガラス管から出た気体が石灰水を通る
- 石灰水が白くにごれば、二酸化炭素が発生した証拠!
💡 覚えよう:
「石灰水が白くにごる → 二酸化炭素がある」
実験の注意点|逆流と酸化に気をつけよう
この実験には大事な注意点が2つあります。
① 石灰水の逆流を防ぐ
加熱を終えたときに、ガラス管の先を石灰水につけたままにしていると、空気の流れが止まり、石灰水が逆流して実験管に入ってしまうことがあります。
🔥 必ず火を消す前に、ガラス管を石灰水から抜いておくこと!
② 銅の再酸化を防ぐ
還元が終わったあと、ピンチコック(空気の流れを止める器具)を開けたままだと、空気中の酸素が装置に入り込んで、せっかくできた銅がまた酸化されてしまうことがあります。
🔒 ピンチコックはしっかり閉じて、空気を遮断しよう!
このように、酸化銅を炭素で還元する実験では、赤い銅が出てくるようすや、石灰水の変化など、目で見てわかるポイントが多くあります。
しっかりと実験手順と注意点をおさえておきましょう!
酸化銅を水素で還元する実験
実験のしかたと化学反応式
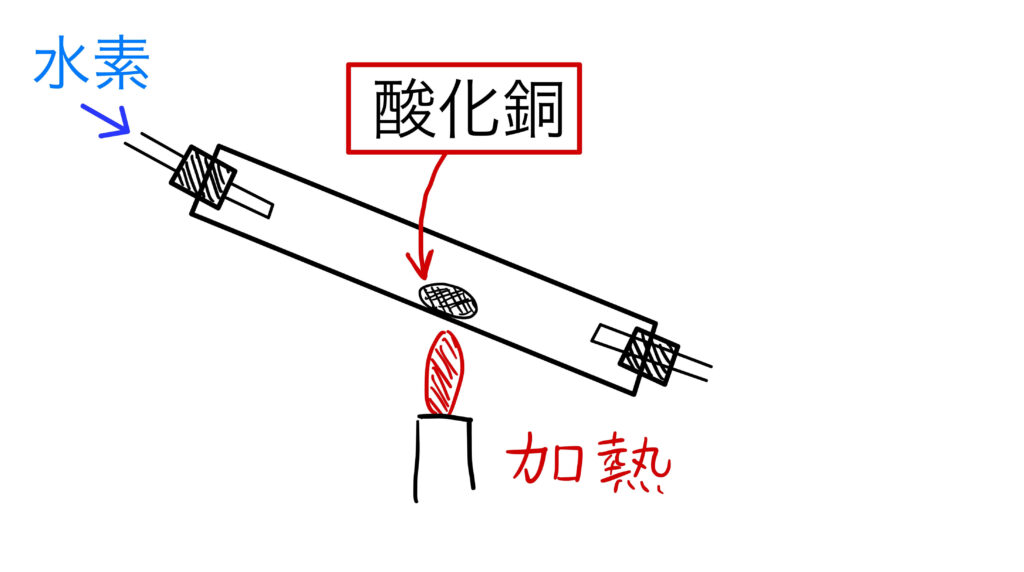
酸化銅(CuO)は、水素(H₂)を使っても還元することができます。
水素は無色・無臭の気体で、とても燃えやすい(可燃性)ので取り扱いには注意が必要です。
酸化銅と水素を一緒に加熱すると、以下のような化学反応が起こります:
CuO + H₂ → Cu + H₂O
- CuO(酸化銅)…黒い
- H₂(水素)…気体(無色・無臭)
- Cu(銅)…赤い金属
- H₂O(水)…気体(水蒸気)
この反応でも、酸化銅(黒)が金属の銅(赤)に変わります。
つまり、水素が酸素をうばって、銅が元に戻る=還元なのです。
発生した水を確認しよう
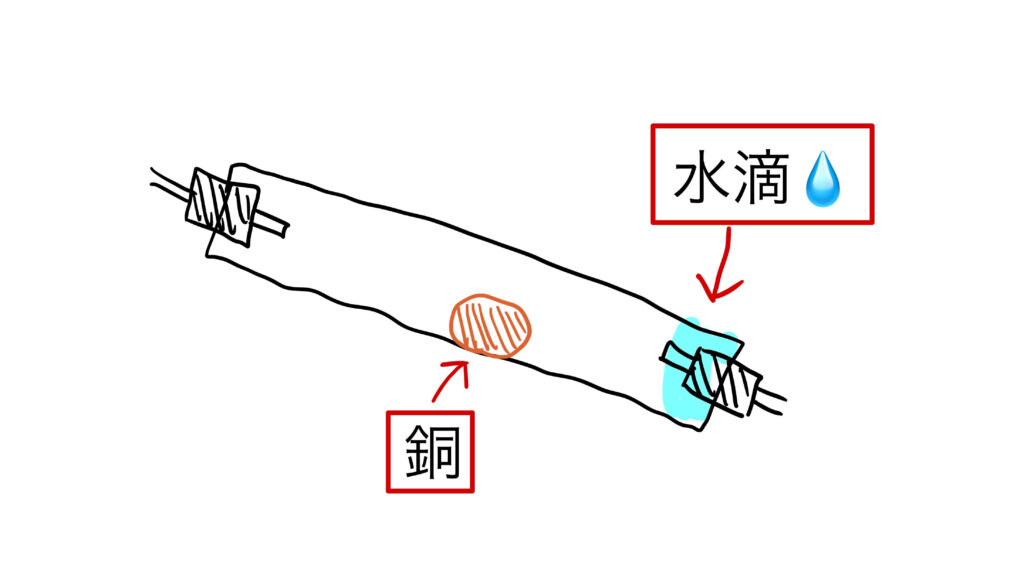
水素で酸化銅を還元すると、水(H₂O)が発生します。
この水は、水蒸気として出てきて、冷やされると試験管の口などに白いしずく(=水滴)となって現れます。
🔍 ポイント:
水素と反応してできるのは 二酸化炭素ではなく水!
【確認方法】
- 酸化銅に水素を流しながら加熱する
- 試験管の口に注目する
- 加熱後、冷えた部分に白いしずく(水滴)がついていれば水ができた証拠!
💡補足:
この水は空気中の水ではなく、化学反応でできた水です。
このように、炭素を使った還元では二酸化炭素(CO₂)が出ましたが、水素を使うと水(H₂O)ができます。
まとめ|「還元」は化学変化の重要ポイント!
今回学んだ「還元」は、酸化と並んでとても大切な化学変化のひとつです。特に中学理科では、酸化銅をもとに戻す実験がよく出てきます。
- 酸化銅を炭素で加熱 → 二酸化炭素が出て、銅に戻る
- 酸化銅を水素で加熱 → 水ができて、銅に戻る
このように、黒い酸化銅が赤い銅に変わるのが還元のポイントです。
🔍 ポイントまとめ
・「酸化」=酸素とくっつくこと
・「還元」=酸素をうばわれること
・「酸化と還元」はセットで理解しよう!
また、実験では火を使ったりガスを発生させたりするため、安全に気をつけることも重要です。
- 石灰水の逆流を防ぐためにガラス管は早めに抜く
- ピンチコックを閉じて空気が入らないようにする
- 水素は可燃性なので取り扱い注意!
しっかりと化学変化のしくみと実験のポイントを理解して、定期テストや高校内容につなげていきましょう!